1. Định nghĩa Anken
-
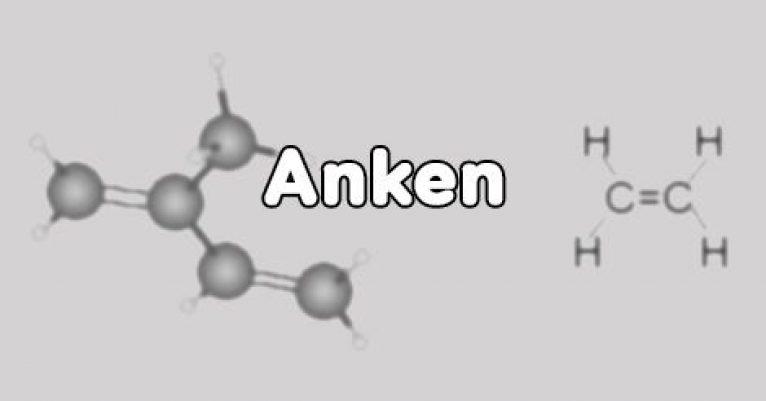
Anken (olefin) là các hidrocacbon không no, mạch hở, có một liên kết đôi C=C trong phân tử và các liên kết khác đều là liên kết đơn.
-
Công thức đơn giản nhất của Anken là CH2=CH2.
2. Công thức và cách gọi tên Anken
2.1. Công thức tổng quát
Công thức tổng quát của Anken là CnH2n.
2.2. Cách gọi tên Anken
Có hai cách gọi tên Anken: tên thông thường và tên thay thế.
2.2.1. Tên thông thường
Tên thông thường là tên Ankan có số nguyên tử cacbon ban đầu, sau đó thay đổi hậu tố -an thành -ilen.
Ví dụ: CH2=CH2 được gọi là etilen
2.2.2. Tên thay thế
Tên thay thế được đặt theo thứ tự chỉ số vị trí nhánh – tên nhánh – chỉ vị trí của liên kết đôi – en
Ví dụ: CH2=CH-CH2-CH3 được gọi là but-1-en
3. Tính chất vật lý của Anken
-
Các Anken từ C2 → C4 tồn tại dưới dạng khí, từ C5 trở lên là chất lỏng hoặc rắn (ở điều kiện thường).
-
Khi khối lượng phân tử tăng, nhiệt độ sôi, khối lượng riêng và nhiệt độ nóng chảy cũng tăng.
-
Anken nhẹ hơn nước.
-
Anken ít tan trong nước nhưng tan được trong một số dung môi hữu cơ như rượu, ete,…
-
Các Anken không có màu.
Tham khảo ngay bộ tài liệu tổng hợp trọn bộ kiến thức và phương pháp giải mọi dạng bài tập trong đề thi Hóa THPT độc quyền của VUIHOC

4. Tính chất hoá học của Anken
4.1. Phản ứng cộng hidro (Anken + H2)
Phương trình tổng quát của phản ứng cộng hidro là:
CnH2n + H2 $xrightarrow{Ni,t^{o}}$ CnH2n+2
4.2. Phản ứng cộng halogen
Phản ứng cộng halogen còn được gọi là phản ứng halogen hóa.
Phản ứng cộng với Brom:
CH2=CH2 + Br2 → Br-CH2-CH2-Br
Phản ứng này được sử dụng để nhận biết Anken.
Phản ứng cộng với Clo:
CH2=CH2 + Cl2 → Cl-CH2-CH2-Cl
4.3. Phản ứng cộng Hiđro halogenua
-
Anken + HCl
CH2=CH2 + HCl → CH3-CH2Cl
Lưu ý: Đồng đẳng của etilen khi phản ứng sẽ tạo ra hỗn hợp các sản phẩm trong đó sản phẩm chính và sản phẩm phụ.
CH3-CH=CH2 + HCl → CH3-CHCl-CH3 (sản phẩm chính) + CH3-CH2-CH2-Cl (sản phẩm phụ)
-
Anken + HBr
CH2=CH2+HBr → CH3-CH2-Br
Lưu ý:
-
Phản ứng diễn ra dễ dần theo dãy HCl, HBr, HI.
-
Phản ứng cộng HX vào anken không hoạt định tạo ra hỗn hợp gồm hai sản phẩm.
-
Đối với các anken không hoạt định khác, phản ứng cộng HX tuân theo quy tắc Markovnikov.
Quy tắc Markovnikov có thể hiểu là ưu tiên cộng vào nguyên tử carbon bậc thấp hơn trước, còn đối với nguyên tử hoặc nhóm nguyên tử X, ưu tiên cộng vào nguyên tử cacbon bậc cao hơn trong phản ứng cộng HX vào liên kết ba, nguyên tử H.
4.4. Phản ứng cộng nước (đun nóng, có axit loãng xúc tác)
4.4.1. Phản ứng cộng nước của Etilen:
CH2=CH2+H2O $xrightarrow{H^{+}_{loang},t^{o}}$ CH3-CH2-OH
4.4.2. Các đồng đẳng của Etilen
CH3-CH=CH2+H2O → CH3-CHOH-CH3 (sản phẩm chính)
+CH3-CH2-CH2-OH (sản phẩm phụ)
Chú ý: Đối với các anken không hoạt định khác, khi cộng nước tuân theo quy tắc Markovnikov: nhóm -OH gắn vào carbon bậc cao.
4.5. Phản ứng trùng hợp
-
Với điều kiện có xúc tác, đun nóng, áp suất cao.
n$_{CH_{2}}$ = CH2 $xrightarrow{p,xt,t^{o}}$ (-CH2-CH2-)n (Polyetylen hay PE)
$n_{CH_{2}}=CH-CH_{3} xrightarrow{p,xt,t^{o}}$ (-CH$_{2}$-CH(CH$_{3}$)-)$_{n}$ (Polypropylen hay PP)
-
Sơ đồ phản ứng trùng hợp: nA $xrightarrow{p,xt,t^{o}}$ (B)n
-
Vậy quá trình cộng hợp liên tiếp nhiều phân tử nhỏ giống nhau hoặc tương tự nhau tạo thành phân tử lớn (hợp chất có phân tử trọng) được gọi là phản ứng trùng hợp.
4.6. Phản ứng oxi hóa
4.6.1. Phản ứng oxi hóa không hoàn toàn
-
Phản ứng oxi hóa không hoàn toàn của Anken tạo thành ancol đa chức có 2 nhóm -OH hoặc đứt mạch C tạo thành anđehit hoặc axit.
-
Anken + KMnO4 ⇒ Dung dịch thuốc tím bị mất màu bởi Anken.
-
Tổng quát:
2CnH2n + 2KMnO4 + 4H2O → 3CnH2n(OH)2 + 2KOH + 2MNO2
-
Nhận xét: có thể sử dụng dung dịch KMnO4 để nhận biết Anken vì nó làm mất màu dung dịch KMnO4.
4.6.2. Phản ứng cháy (oxi hóa hoàn toàn)
-
Phương trình tổng quát: CnH2n + $frac{3n}{2}$O2 → nCO2 + nH2O
-
Chú ý: Đặc điểm phản ứng cháy Anken là nCO2 = nH2O
5. Điều chế Anken
5.1. Trong phòng thí nghiệm
-
Điều chế Anken từ tách nước từ ancol etylic:
Phương trình tổng quát: CnH2n+1OH $xrightarrow{H2SO4,geq17^{o}C}$ CnH2n + H2O
Ví dụ: C2H5OH $xrightarrow{H2SO4,geq17^{o}C}$ C2H4 + H2O
5.2. Trong công nghiệp
-
Chế Anken từ khí thành phẩm của quá trình chế biến dầu mỏ.
-
Tách H2 từ Ankan:
Phương trình tổng quát: CnH2n+2 $xrightarrow{Fe,t^{o}C}$ CnH2n + H2
-
Tách HX từ dẫn xuất CnH2n+1X
Phương trình tổng quát: CnH2n+1X + NaOH $xrightarrow{anol}$ C$_{n_{H_{2n}}}$ + Na + H2O
-
Từ dẫn xuất đihalogen tách X2 (2 nguyên tử C liền kề kết nối với 2 nguyên tử halogen)
Phương trình tổng quát: CnH2nX2 + Zn $xrightarrow{t^{o}}$ CnH2n + ZnBr2
-
Chất Ankin hoặc Ankadien cộng H2 với xúc tác Pd/PbCO3:
Phương trình tổng quát: CnH2n-2 + H2 → CnH2n
Đăng ký ngay để được tư vấn và xây dựng lộ trình ôn tập hiệu quả và phù hợp nhất với bản thân

6. Một số bài tập trắc nghiệm về Anken (có đáp án)
Câu 1: Đồng đẳng nào trong các đồng đẳng sau của etilen có %C = 85,71%?
A. Hexilen
B. Butilen
C. Etilen
D. Tất cả các câu trên
Lời giải: Đáp án D. Vì:
Công thức chung của Anken là CnH2n
%C = $frac{12n}{14n}$ = 85,71%
Vậy với mọi %C đều bằng 85,71%.
Câu 2: Bài cho chất X có công thức CH3-CH(CH3)-CH=CH2. Tên thay thế của X là?
A. 3-metylbut-1-in
B. 3-metylbut-1-en
C. 2-metylbut-3-en
D. 2-metylbut-3-in
Lời giải: Đáp án B
Câu 3: Tên khác của dãy đồng đẳng Anken là:
A. Hidrocacbon không no
B. Parafin
C. Olefin
D. Hidrocacbon chưa bão hòa
Lời giải: Đáp án C
Anken còn gọi là olefin.
Câu 4: Số đồng phân cấu tạo mạch hở ứng với công thức phân tử C4H8 là:
A. 5
B. 4
C. 8
D. 3
Lời giải: Đáp án D
Các đồng phân cấu tạo mạch hở ứng với công thức C4H8 là
CH2=CH-CH2-CH3
CH3-CH=CH-CH3
CH2=C(CH3)2
Vậy có 3 đồng phân cấu tạo.
Câu 5: Phản ứng nào được sử dụng để phân biệt etan và eten?
A. Phản ứng với dung dịch brom
B. Phản ứng cộng hidro
C. Phản ứng trùng hợp
D. Phản ứng đốt cháy
Lời giải: Đáp án A vì khi dẫn hỗn hợp khí qua dung dịch brom thì khí etan không phản ứng với dung dịch Brom thoát ra khỏi dung dịch, trong khi khí eten làm mất màu dung dịch Brom.
CH2=CH2 + Br2 → CH2Br-CH2Br
Câu 6: Trong các hidrocacbon sau đây, chất nào phản ứng với dung dịch Brom tạo thành 1,2-đibrombutan?
A. But-1-en
B. But-2-en
C. 2-metylpropen
D. Butan
Lời giải: Đáp án A vì:
CH2=CH-CH2-CH3 + Br → CH2Br-CHBr-CH2-CH3
(But-1-en) (1,2-đibrombutan)
Câu 7: Để khử hoàn toàn 200ml dung dịch KMnO4 0,2M tạo thành chất rắn màu đen cần V(lít) C2H4(đktc). Giá trị của V là:
A. 1,344
B. 4,480
C. 2,240
D. 2,688
Lời giải: Đáp án A
Ta có phương trình:
3C2H4 + 2KMnO4 + 4H2O3 → C2H4(OH)2 + 2MnO2(đen) + 2KOH
n$_{KMnO_{4}}$ = 0,2 x 0,2 = 0,04 mol
Theo phương trình trên ta có:
n$_{C_{2}H_{4}}$ = $frac{3}{2}$n$_{KMnO_{4}}$ = 32 x n$_{KMnO_{4}}$ = 32 x 0,04 = 0,06 mol
V = 0,06 x 22,4 = 1,344 lít
Câu 8: Khi thực hiện phản ứng trùng hợp etilen với hiệu suất 80%, thu được 1 tấn polyetylen. Giá trị của m là:
A. 2
B. 0,8
C. 1,8
D. 1,25
Lời giải: Đáp án D
Khối lượng polyetylen = khối lượng metilen (lý thuyết) = 1 tấn (khối lượng bảo toàn)
→ khối lượng metilen (thực tế) = 1 x 100/80 = 1,25 tấn
Câu 9: Cho hỗn hợp X gồm propen và một anken đồng đẳng khác. Khi đốt cháy hoàn toàn 1 mol hỗn hợp X, cần 4,75 mol O2. Vậy anken còn lại trong X có thể là:
A. Eten
B. Propan
C. Buten
D. Etan
Lời giải: Đáp án C
CnH2n + $frac{3n}{2}$O2 xrightarrow{th} nCO2 + nH2O
1 4,75 mol
1.$frac{3n}{2}$ = 4,75
n = 3,17
Vậy chất còn lại phải có số nguyên tử Carbon lớn hơn 3 (vì hỗn hợp chứa propen có 3C)
Dựa vào đáp án, chọn C4H8
Câu 10: Xác định công thức cấu tạo của chất X khi thực hiện thí nghiệm đốt cháy hoàn toàn 10ml hidrocacbon X mạch hở thu được 40ml CO2 ở cùng điều kiện nhiệt độ, áp suất. Biết chất X có cấu trúc mạch phân nhánh và làm mất màu dd Brom.
Lời giải:
10ml X → 40ml CO2
Số nguyên tử cacbon trong X = $frac{V_{CO_{2}}}{V_{X}}$ = 4
Chất cho X làm mất màu dung dịch Brom nên suy ra X không no và mạch hở, có 4C
Vậy X có công thức (CH3)2C = CH2
Bài viết trên đã tổng hợp các lý thuyết quan trọng về Anken trong môn hoá 11 bao gồm công thức cấu tạo, cách gọi tên, tính chất vật lý, tính chất hoá học và các ví dụ về các dạng bài tập liên quan đến Anken. Hy vọng rằng với bài viết này, các em học sinh sẽ có thể làm tốt các dạng bài tập về Anken. Để có kết quả tốt nhất, hãy truy cập trang web Vuihoc.vn và đăng ký tài khoản để luyện tập ngay hôm nay!